
ACS Central Science | 以不变应万变:黄牛实验室利用虚拟筛选方法发现可调控新冠病毒刺突蛋白构象转变的小分子调节剂
导读:
新型冠状病毒(SARS-CoV-2)利用其包膜上的三聚体刺突(spike)蛋白与宿主细胞ACE2受体结合以介导病毒的入侵(视频1)。由于在感染过程中的重要作用,spike蛋白是疫苗和抗体药物研发的主要靶标。尽管国内外已有针对spike蛋白的批准或紧急使用授权的疫苗、抗体药物用于临床,但随着变异株的不断出现及流行,尤其是spike蛋白成为突变热点,对疫苗的保护率和抗体药物的治疗效果提出了严峻的挑战。相比抗体药物而言,小分子药物具有对突变不敏感、可口服给药、生产运输成本低等潜力,是一种有前景的新冠病毒治疗方案。目前没有针对spike蛋白的小分子候选化合物进入临床研究,多角度开发新冠病毒的新型预防和治疗药物仍刻不容缓。
视频1 融合前spike蛋白的两种构象状态
这三年来,肆虐全球的新冠病毒变化多端,从原始株开始,演化出阿尔法、贝塔、伽马、德尔塔,直到现在奥密克戎又成为最流行毒株,还分化出不同亚型,至于将来如何变幻,难以预料。但万变不离其宗,新冠病毒再变幻无穷,也仍然遵循病毒的生活史,遵循吸附、进入、脱壳、复制、成熟和释放的生命周期。针对新冠病毒进行的新药研发也是围绕着这几个关键节点进行。抑制已入侵细胞的病毒复制已有多个小分子药物批准上市或者紧急使用授权,如3CL蛋白酶抑制剂Paxlovid和Ensitrelvir,如RdRp抑制剂Remdesivir和Molnupiravir。但直接阻断新冠病毒进入细胞的途径,尚未有一款小分子药物进入临床研究,虽然这条途径已经被抗体和疫苗验证了其可行性,但这类生物药却经常因为新冠病毒spike蛋白变异而失效。2020年Toelzer等人在Science等杂志连续发文,发现spike蛋白虽然多变,却具有一个非常保守的游离脂肪酸(free fatty acid, FFA)结合位点,调控该位点可以有效地抑制病毒进入细胞,称其为新冠的阿喀琉斯之踵。可惜的是,因为其结合位点的特殊性,只报道过几个偶然发现的天然产物,尚未找到可成药的小分子。
那么,面对新冠多变的spike蛋白,以不变应万变,是否可以通过基于结构的虚拟筛选,精确地靶向新冠病毒的七寸——游离脂肪酸结合位点——射出这一箭?
2023年2月8日,北京生命科学研究所/清华大学生物医学交叉研究院黄牛实验室与天津大学药学院黄剑辉教授及水木未来(北京)科技有限公司合作,在美国化学会旗舰杂志ACS Central Science杂志上发表题为“In Silico Discovery of Small Molecule Modulators Targeting the Achilles’ Heel of SARS-CoV-2 Spike Protein”的文章。该研究针对SARS-CoV-2 spike蛋白保守的游离脂肪酸(free fatty acid, FFA)结合位点,通过大规模虚拟筛选策略发现苗头化合物并随后对其进行优化,得到一系列低摩尔级别结合活性的小分子化合物。随后冷冻电镜研究确定了小分子在FFA结合位点的结合模式,并且揭示了小分子的结合使spike蛋白的构象平衡向“闭合”状态方向转变,即无法与ACE2受体结合的构象状态。该研究在一定程度上表明针对保守的FFA结合位点发现的小分子调节剂有望开发成为预防和治疗冠状病毒的广谱药物,并且联合其他作用机制的药物如3CL蛋白酶抑制剂等,达到鸡尾酒疗法的效果。
- “新药发现的源泉”——生物学新机制
新药研发的源泉是新的生物学机制/新靶点。SARS-CoV-2利用其包膜上的三聚体spike蛋白与宿主细胞ACE2受体结合以介导病毒的入侵。融合前的spike蛋白主要有两种构象状态,一种是三个受体结合域(receptor-binding domain,RBD)都处于“向下”构象的“闭合”状态(图1A),另一种是有一个或多个RBD处于“向上”构象的“开放”状态,而只有“向上”构象的RBD才能与ACE2结合(图1B)。与新冠病毒原始株相比,计算模拟及结构生物学研究均表明近期流行的奥密克戎变异株的spike蛋白构象更偏好与ACE2结合的“开放”状态,这在一定程度上解释了奥密克戎毒株传播性更强的现象。
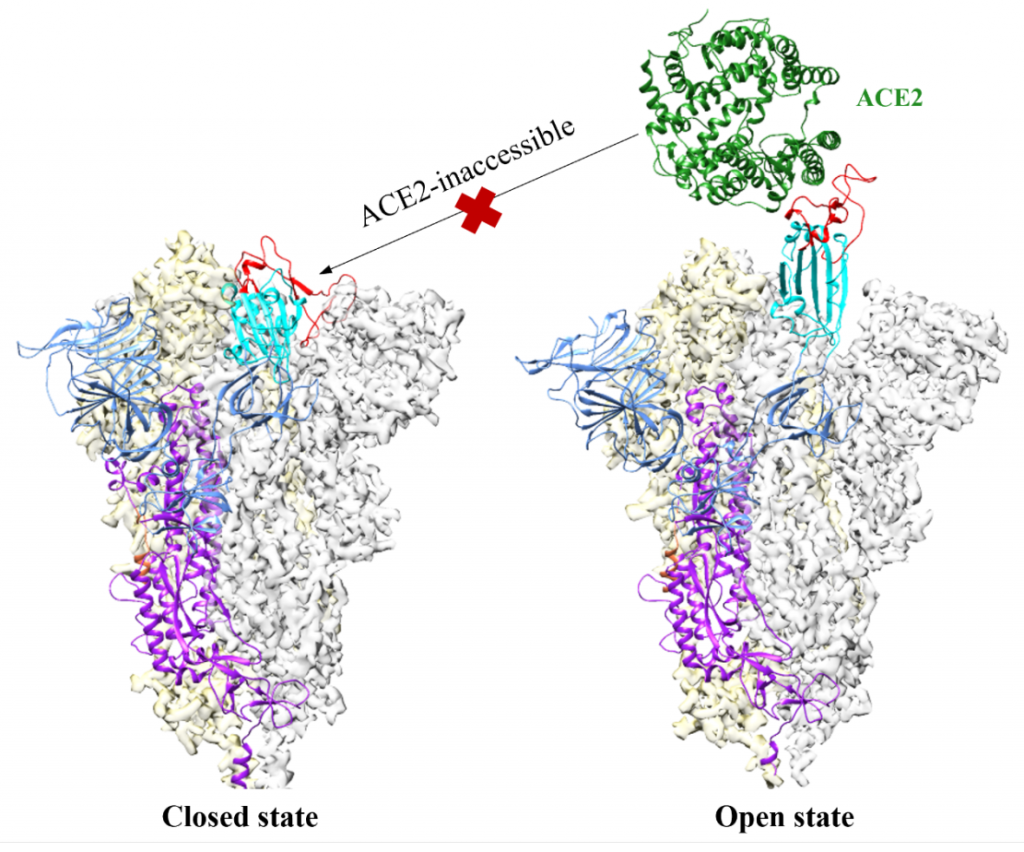
图1 融合前spike蛋白的两种构象状态:“闭合”(左)和“开放”(右)
Toelzer等人在电镜研究中意外发现亚油酸分子结合在三个由spike蛋白中的两个相邻RBDs组成的复合型结合口袋中。与apo spike相比,亚油酸的结合使得spike蛋白中三个RBDs之间的结合更加紧密,将spike构象锁定在无法与ACE2结合的“闭合”状态。随后,北京生命科学研究所的郑三多实验室也有类似发现。本研究团队对此FFA结合位点氨基酸残基的保守性进行了分析,发现除R408外,其他残基都高度保守,保守性远远高于与ACE2结合界面处的残基(图2)。这启发研究团队,针对此保守的FFA结合位点开发小分子调节剂,有望以变构调节的方式改变spike蛋白的构象偏好,进而干扰病毒侵染细胞的过程。
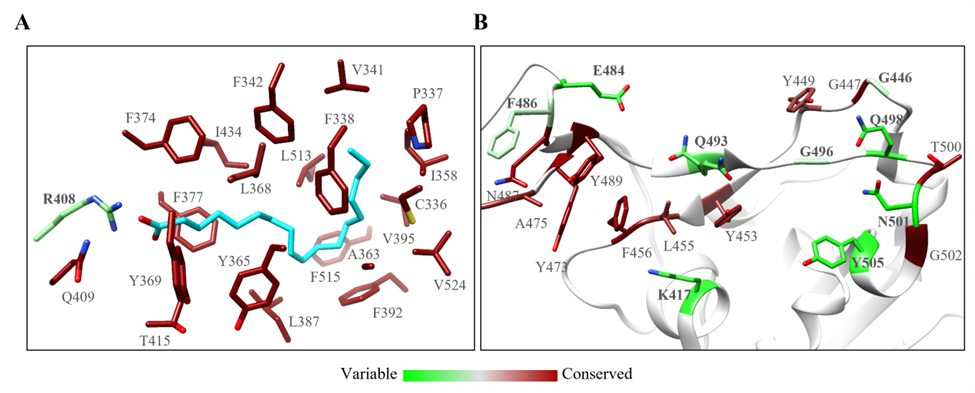
图2 (A)FFA结合位点残基与(B)ACE2结合界面处残基的保守性比较
- “雪中送炭”——基于靶标结构的虚拟筛选
解决传统方法很难解决的问题,是新技术的重要价值所在。开发spike蛋白的小分子构象调节剂,难以通过建立高通量实验筛选方法进行,因此基于结构的虚拟筛选方法成为寻找FFA结合位点小分子配体的一把利器。研究团队针对FFA结合口袋,利用黄牛实验室多年发展的逐级虚拟筛选技术(图3),先对北生所内部的化合物库(32余万分子)进行分子对接,接着对打分排名前6万的化合物做更高计算精度的基于MM-GB/SA方法的优化及重打分,随后系统分析打分排名前1000的化合物结合模式,最终挑取了54个化合物做SPR实验验证(图3A)。结果表明,6个化合物显示微摩尔级别的结合活性(图3B)。为了提高化合物的活性及溶解性,在经过可合成性评估后,研究团队合成了SPC-2的含羧基基团的类似物,得到结合活性为4.8微摩尔的化合物(图4)。并且,这类化合物对奥密克戎BA.4(spike蛋白包含R408S突变)也表现出类似结合活性,表明化合物的结合不受R408突变的影响。这个结果,除再次验证了我们计算技术的实战能力之外,也在一定程度上佐证了我们“以不变应万变”的策略,用小分子调控保守的FFA结合口袋,针对易突变的新冠病毒具有一定的优势。
恰如黄牛实验室最近在Int J Mol Sci应邀发表的综述性论文中强调的,虚拟筛选技术只有被用在新靶标上,发现生物活性分子作为先导化合物进行后继开发,或作为化学探针来研究细胞和生物体中的靶标功能,才能为新药研发做出“雪中送炭”的实质性贡献。
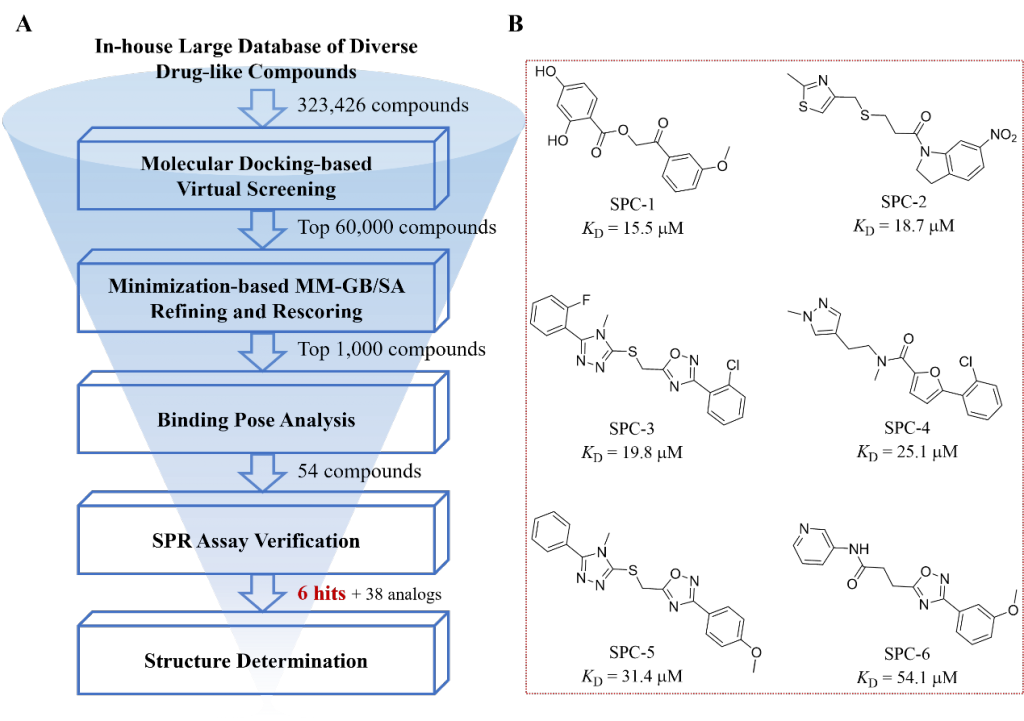
图3 (A)逐级虚拟筛选策略流程图及其(B)发现的苗头化合物
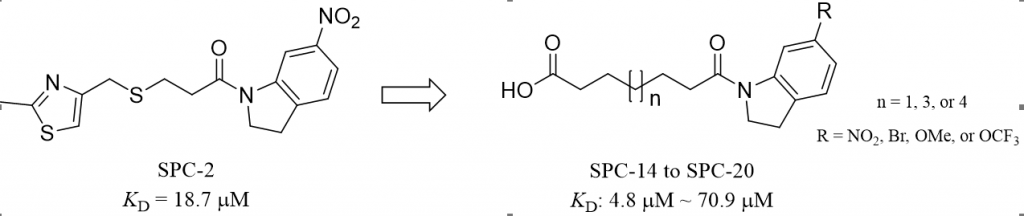
图4 苗头化合物的SAR研究
- “有图有真相” ——复合物结构的测定
为了确定化合物的结合模式及其对spike蛋白构象偏好的影响,研究团队将纯化的spike蛋白与含羧基化合物SPC-14(KD = 9.5 μM)一起孵育制备冷冻电镜样品,并以单独的spike蛋白体系作为空白对照。电镜结果表明,对于有SPC-14加入的体系,约48%的粒子处于“关闭”状态,另外52%处于有一个RBD向上的“开放”状态。而对于apo spike体系,几乎100% 都处于一个RBD向上的“开放”状态,这表明SPC-14的加入会影响spike蛋白的构象偏好(图5A)。同时,在“关闭”状态的spike+SPC-14体系中发现了多余的电子云密度,此密度正好位于FFA结合位点并且SPC-14的分子结构能够很好的与其契合(图5B)。
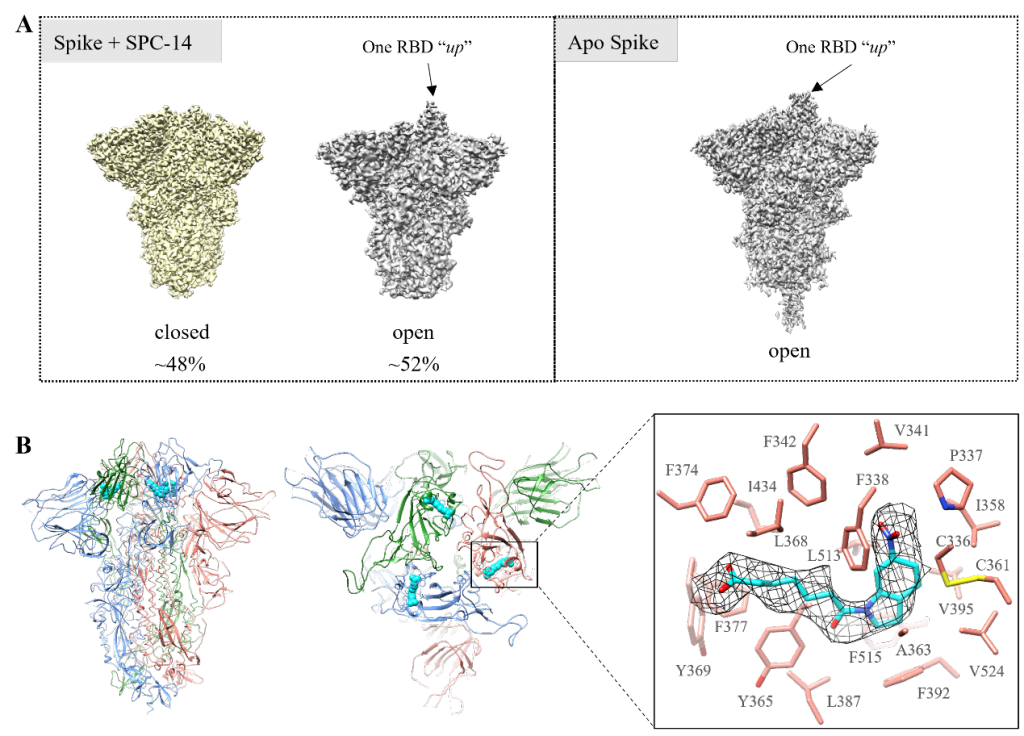
图5(A)spike蛋白在有无SPC-14加入下的冷冻电镜密度图。(B)spike蛋白与SPC-14复合物的电镜结构。
- “路漫漫其修远兮” ——未来可期
综上,此研究首次利用基于结构的虚拟筛选手段发现并且实验验证了一系列对spike蛋白有结合活性的小分子,在传统实验筛选方法很难解决的情况下,计算可谓起到了雪中送炭的作用。虽然早在2020年底就已完成虚拟筛选计算工作,区别于新冠病毒爆发早期的很多没有实验验证的计算研究,该研究结合SPR测活和最终通过电镜结构解析的实验手段进行了严谨的验证工作。“路漫漫其修远兮”,尽管该研究己发现了一系列低微摩尔级别的spike蛋白小分子调节剂,但结合活性有待进一步提升,小分子对变异毒株的构象偏好影响也有待研究,抗病毒功能也亟待验证。基于该研究中已经解析的小分子与spike蛋白的复合物电镜结构,该研究团队迅速开展分子优化改造,新合成的10多个化合物,结合活性已有近十倍的提升,进一步的电镜结构解析和化合物优化工作正在进行;针对spike蛋白上其它潜在小分子结合位点的虚拟筛选和实验验证工作也已开展。科学就是在一点一滴的进步中实现超越,希望本研究工作能激发更多的针对新冠病毒新机制、新靶标的小分子研发工作,毕竟基础研究的使命是探索未知、原始创新。希望靶向spike蛋白的小分子药物将为预防和治疗冠状病毒的工具箱提供更多的选择!
黄牛实验室的博士研究生王情与水木未来的孟繁昊为本文共同第一作者,黄牛博士与天津大学的黄剑辉教授为通讯作者。其他作者包括黄牛实验室的谢钰婷和刘涛,郑三多博士与其实验室的王巍博士,水木未来的倪晓丹博士,以及中国科学院微生物研究所的齐建勋博士及其实验室的孟玉敏,李霖杰。该研究由北京市科委(生命科学前沿创新培育项目)和清华大学共同资助。
