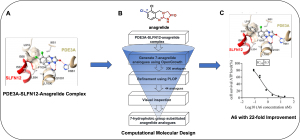
近年来,de Waal、王晓东团队、安然等人相继发现小分子DNMDP、高浓度雌二醇、天然产物nauclefine、PDE3抑制剂anagrelide可以促进PDE3A(phosphodiesterase 3A)和SLFN12(Schlafen family member 12)依赖的细胞凋亡。随后,清华大学王宏伟团队解析了小分子化合物DNMDP,nauclefine,anagrelide结合的PDE3A-SLFN12复合物结构。其中的PDE3A-SLFN12-anagrelide复合物结构显示,结合于PDE3A催化口袋的小分子化合物anagrelide作为分子胶水,“创造”了PDE3A的疏水界面,从而与SLFN12的短螺旋(E552-I558)结合,将两种蛋白质“粘合”在一起,诱导了PDE3A和SLFN12形成稳定的三元复合物。
通过深入分析PDE3A-SLFN12-anagrelide的三元复合物,黄牛团队注意到anagrelide的7位氯原子与PDE3A的T844、F972、L910等残基和SLFN12的I557、I558等残基形成广泛的疏水相互作用(Fig. A)。因此推测,7位氯原子对anagrelide分子胶的作用有重要贡献,对anagrelide凋亡诱导活性也至关重要。基于PDE3A-SLFN12-anagrelide的三元复合物结构和anagrelide 7位氯原子的认知,黄牛团队使用OpenGrowth程序自动对anagrelide 7位的取代基进行采样,期望获得新型的取代基能促进PDE3A和SLFN12之间的相互作用,进而提高小分子化合物的凋亡诱导活性。随后使用MM-GB/SA自由能计算对生成的anagrelide类似物进行亲和力排名。其中排名靠前的以7位取代基为芳环,尤其是苯环或者取代苯环为主。同时,基于对结合模式的理解,团队成员挑选了一批疏水性的取代基(包括苯基)作为优选分子。该计算流程十分高效,一共生成、评价了200个anagrelide 7位取代基的分子,单核10小时内即可完成(Fig. B)。
随后,齐湘兵团队参考计算团队的结果,合成了anagrelide 7 位具有不同疏水性取代的anagrelide类似物,包括芳环或脂肪链。令人鼓舞的是,苯环取代的A4表现出优异的凋亡诱导活性,IC50达到0.56 nM,与anagrelide相比,活性提高了近12倍,甲苯基取代的类似物(A6)取得了最有效的凋亡诱导活性(IC50 = 0.30 nM),比anagrelide提高约22倍(Fig. C)。更重要的是,化合物A6在体内显示出比anagrelide更好的肿瘤生长抑制作用。
该工作由王晓东团队联合王宏伟团队、黄牛团队和齐湘兵团队共同完成。黄牛团队的王元勋博士完成了计算和分子设计的工作。论文发表于Nature Communications杂志上题为
Jie Chen, Nan Liu, Yinpin Huang, Yuanxun Wang, Yuxing Sun, Qingcui Wu, Dianrong Li, Shuanhu Gao, Hong-Wei Wang, Niu Huang, Xiangbing Qi & Xiaodong Wang