
NIBS黄牛实验室、张二荃实验室和BIG杨运桂实验室合作发现FTO抑制剂entacapone通过调控FTO-FOXO1通路治疗代谢综合征
2019年4月17日,北京生命科学研究所(NIBS)黄牛实验室、张二荃实验室与中科院北京基因组研究所(BIG)杨运桂实验室合作,在《Science Translational Medicine》发表题为“Identification of entacapone as a chemical inhibitor of FTO mediating metabolic regulation through FOXO1”的研究论文。作者采用基于蛋白结构的虚拟筛选方法,找到老药—entacapone 作为潜在的FTO抑制剂,在体外和体内实验中验证了其FTO抑制活性,并进一步发现Entacapone通过抑制FTO-FOXO1通路,有治疗肥胖症、糖尿病等代谢综合征的临床应用潜力。
在现代社会中,以肥胖症和糖尿病为代表的代谢综合症,严重影响着人类健康。通过全基因组关联分析(GWAS),科研人员发现FTO基因与肥胖症等代谢综合征密切相关。FTO蛋白为核苷酸去甲基化酶,主要作用于mRNA上的m6A修饰。这一修饰调控着mRNA的转录、剪切、转运和翻译等过程。而之前的研究对于究竟FTO蛋白的去甲基酶活性如何调控代谢平衡,还未被清晰阐述。同时,也并不清楚:针对FTO蛋白,这一重要的生物学靶点,究竟是否可以设计出小分子抑制剂,应用于治疗代谢综合征,如肥胖症和糖尿病。
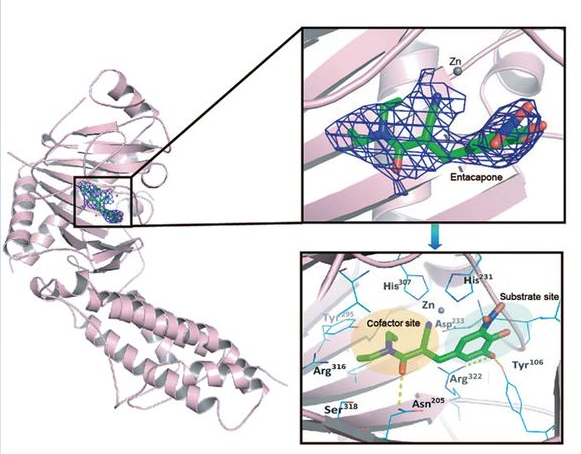
在本研究中,作者采用基于蛋白结构的药物设计方法,针对已有完备的药代动力学和安全性数据的上市药物进行虚拟筛选,得到FTO蛋白抑制剂entacapone。测定了entacapone的抑制活性、选择性和亲和力常数,解析了其与FTO蛋白的复合物晶体结构,进行了entacapone类似物的构效关系分析。作者在高脂饲料诱导的小鼠肥胖模型中,测定了entacapone的减肥效果和降血糖效果。同时,利用 entacapone作为化学工具,结合高通量转录组学测序以及m6A的修饰谱数据,发现了FTO的直接底物之一为FOXO1 mRNA。作者在多种小鼠模型上,均证实了entacapone通过抑制外周组织的FTO-FOXO1通路,在肝脏中调控糖异生过程(gluconeogenesis),在脂肪组织中调控产热过程(thermogenesis),从而可以被应用于治疗肥胖症和糖尿病。
文章首次报道了具有治疗肥胖症和糖尿病药效的FTO蛋白抑制剂,首次阐述了分子水平上FTO去甲基化酶活性与动物生理水平上能量代谢调控之间的因果关系。我们采取的从计算机虚拟筛选、分子水平、细胞水平和动物水平的多层次验证,以及从评估药效到阐释调控机理的策略,希望对转化医学研究有所提示与促进。

黄牛实验室的彭士明博士、杨运桂实验室的肖文博士、张二荃实验室的鞠大鹏博士和杨运桂实验室的孙宝发博士为本文共同第一作者。黄牛实验室的侯楠楠、王艳丽和曹冉博士,张二荃实验室的赵海焦,杨运桂实验室的刘倩兰均对本工作有重要贡献,北生所的智刚博士、赵丽萍博士、王凤超博士和四军大的聂勇战博士提供了动物实验方面的重要支持。杨运桂博士、张二荃博士和黄牛博士为本文共同通讯作者。这项研究得到了北京市科委,国家新药创制重大专项、973计划,国家自然科学基金、中科院、青年千人计划的资助,在北京生命科学研究所和北京基因组研究所完成。
Abstract
Recent studies have established the involvement of the fat mass and obesity-associated gene (FTO) in metabolic disorders such as obesity and diabetes. However, the precise molecular mechanism by which FTO regulates metabolism remains unknown. Here, we used a structure-based virtual screening of U.S. Food and Drug Administration–approved drugs to identify entacapone as a potential FTO inhibitor. Using structural and biochemical studies, we showed that entacapone directly bound to FTO and inhibited FTO activity in vitro. Furthermore, entacapone administration reduced body weight and lowered fasting blood glucose concentrations in diet-induced obese mice. We identified the transcription factor forkhead box protein O1 (FOXO1) mRNA as a direct substrate of FTO, and demonstrated that entacapone elicited its effects on gluconeogenesis in the liver and thermogenesis in adipose tissues in mice by acting on an FTO-FOXO1 regulatory axis.
